Ozeandüngung: Unterschied zwischen den Versionen
KKeine Bearbeitungszusammenfassung |
|||
| Zeile 107: | Zeile 107: | ||
== Lizenzhinweis == | == Lizenzhinweis == | ||
{{CC-Lizenz}} | {{CC-Lizenz}} | ||
{{ | {{Kontakt}} | ||
<metakeywords>DBS-Wiki-KW, Atmosphäre, Ozean</metakeywords> | <metakeywords>DBS-Wiki-KW, Atmosphäre, Ozean</metakeywords> | ||
Version vom 19. November 2022, 19:40 Uhr
Das politische Ziel, die Klimaerwärmung durch den Menschen auf höchstens 2 °C unter dem vorindustriellen Wert zu begrenzen, um einen ‚gefährlichen Klimawandel‘ zu vermeiden, gilt vielen Experten als nicht mehr erreichbar. Daher werden verschiedene Möglichkeiten diskutiert, durch sogenanntes Climate Engineering den Klimawandel zu begrenzen. Neben der Verringerung der Sonnenstrahlung zur Abkühlung der Atmosphäre (vgl. den Artikel „Modifikation mariner Schichtwolken“) werden auch Maßnahmen, die das vom Menschen emittierte Kohlendioxid wieder aus der Atmosphäre entfernen, in Erwägung gezogen. Eine dieser Maßnahmen ist die Eisendüngung bestimmter Gebiete des Ozeans, um auf diese Weise das Algenwachstum zu verstärken und mehr CO2 aus der Atmosphäre zu binden.
Methode
Große Teile des Ozeans sind so nährstoffarm, dass das Wachstum einzelliger Algen durch den Nährstoffmangel limitiert ist. Das betrifft zum Beispiel den tropischen Ostpazifik, Teile des Nordpazifiks und den gesamten Südliche Ozean. Sie werden auch als HNLC-Regionen bezeichnet (HNLC = High Nutrient, Low Chlorophyll), in denen kaum Algen wachsen und damit ein geringer Chlorophyll-Anteil vorherrscht.[1] Hier setzt die Ozeandüngung an: Es können sowohl Makronährstoffe wie Phosphor und Stickstoff in großen Mengen als auch – in geringen Mengen – Mikronährstoffe wie Eisen ins Meer eingebracht werden. Die Wahl hängt davon ab, welche Nährstoffe das Phytoplankton zum Wachstum benötigt.[2] Das Ziel der Ozeandüngung ist es, einen Teil des atmosphärischen CO2 für einen längeren Zeitraum im Meer zu speichern und so die CO2-Konzentration der Atmosphäre zu senken. Je nach Stabilität kann CO2 für 10 – 100 Jahre der Atmosphäre entzogen werden.
Kohlendioxid wird zunächst aus der Atmosphäre im Ozeanwasser gelöst und wird anschließend fast vollständig in andere Kohlenstoffverbindungen, z.B. in Hydrogenkarbonat, umgewandelt (s. Kohlenstoff im Ozean). Verbleibendes Kohlendioxid und Hydrogenkarbonat wird durch Photosynthese vom Phytoplankton, d.h. von verschiedenen Algenarten, aufgenommen. Die Fixierung des in Meerwasser gelösten CO2 im Phytoplankton bewirkt, dass der Partialdruck in der ozeanischen Deckschicht gegenüber dem atmosphärischen CO2-Partialdruck sinkt. Da sich die Atmosphäre und der Ozean immer im Gleichgewicht befinden, wird sich mehr Kohlenstoffdioxid im Wasser lösen. Dieser Effekt ist umso größer, je größer und langlebiger die Algenblüte ist. Diese hängt wiederum von dem Nährstoffangebot, der Artenzusammensetzung des Phytoplanktons und der Anzahl der Fressfeinde ab.
Damit eine dauerhafte CO2-Speicherung gelingt, muss das in Biomasse gespeicherte CO2 in die Tiefsee sinken. Das betrifft das abgestorbene Phytoplankton und die Ausscheidungen ihrer Konsumenten (z.B. Zooplankton). Durch den Einfluss von Strömungen und Turbulenz sowie durch den mikrobiologischen Abbau sinkt jedoch nicht der gesamte Kohlenstoff auf den Meeresboden, wo er als Meeressediment abgelagert wird; ein Teil gelangt auch zurück in die oberen Meeresschichten. Dabei entstehen Zwischenprodukte, die dem Zooplankton als Nahrung dienen. Dieses gibt bei der Respiration wieder CO2 ab und wird von den nächst höheren Meeresorganismen gefressen.
Selbst wenn der Abbau erst in großen Tiefen geschieht, wird das CO2 mit der globalen Ozeanzirkulation in einigen 100 bis 1000 Jahren wieder in die Atmosphäre gelangen.[1]
Eisen in den Meeren
1990 stellte der Ozeanograph John Martin die Eisenhypothese auf, nach der die Produktivität von Phytoplankton in nährstoffreichen, aber weniger produktiven Meeresregionen (z.B. dem Südlichem Ozean) durch die begrenzte Verfügbarkeit von Eisen limitiert ist. Er beobachtete, dass die natürliche Düngung mit eisenhaltigen Staubpartikeln aus der Atmosphäre die Algenblüte anregt. Stirbt das Phytoplankton nach der Algenblüte ab, sinkt Biomasse zum Meeresboden.[3]
Eisen ist das zweithäufigste chemische Element der Erde, der größte Anteil davon befindet sich im Erdkern.[1] Es ist essentiell für das Wachstum und den Stoffwechsel aller Meereslebewesen; außerdem bildet Phytoplankton mithilfe des Eisens Chlorophyll, womit Eisen die Grundlage für die Photosynthese ist.
Die biologische Verfügbarkeit von Eisen im Meerwasser richtet sich nach bestimmten Faktoren. Der wichtigste ist die Konzentration an gelöstem Sauerstoff. Bei hohen Konzentrationen ist die Menge an gelöstem Eisen nur sehr gering (0.2 – 2 nmol/l). In suboxischen (sauerstoffarmen) und anoxischen (sauerstofffreien) Regionen liegt die Konzentration an gelöstem Eisen hingegen bei 300 – 3000 nmol/l. Dieser Wert wird nur in Porenwässern der marinen Sedimente mit 300µmol/l und an Hydrothermalquellen mit 3mmol/l übertroffen. Die Einheit mol/l beschreibt die Stoffmenge (molare Masse) pro Liter (mol/l) (mmol = Millimol, µmol = Mikromol, nmol = Nanomol).
Zusätzlich ist wichtig, ob in der euphotischen Zone, d.h. in der lichtdurchlässigen oberen Wasserschicht, natürliche Quellen für Eisen vorhanden sind. Quellen können terrestrische eisenhaltige Staubpartikel sein, die direkt als Deposition auf dem Meer abgelagert oder durch Schmelzwasser eingetragen werden. Auch der Zustrom von Flüssen, die stabile Formen an Eisen (z.B. Humine) in hohen Konzentrationen mit sich führen, kann eine Quelle sein. Aufsteigendes Tiefenwasser (upwelling), z.B. bei dem Schelf der Karguelen Islands, und Turbulenz und Diffusion können ebenfalls dazu führen, dass Eisen in die obere Wasserschicht eingetragen wird. Eine letzte Quelle könnten submarine Vulkane in flachen Meeren sein.
Generell konnte beobachtet werden, dass die Eisenkonzentrationen in den oberflächennahen Schichten in Küstennähe größer sind als im offenen Ozean.[3]
Potential
Da Eisen nicht in allen Ozeangebieten für die Bildung von Chlorophyll ausreichend vorhanden ist, könnte eine künstliche Zufuhr das Algenwachstum verstärken.
Das Potential der Ozeandüngung zum Entzug von CO2 aus der Atmosphäre wurde zunächst aufgrund theoretischer Berechnungen als vielversprechend eingeschätzt: Die Leistung der biologischen Pumpe sollte um 10% gesteigert werden, sodass die Entfernung einer Gigatonne Kohlenstoff pro Jahr aus der Atmosphäre als möglich erschien. Gelänge es, alle ungenutzten Nährstoffe des Südlichen Ozeans (dessen Fläche bei 50 Millionen km² liegt) in den nächsten 100 Jahren in Phytoplanktonbiomasse umzuwandeln (eine sehr extreme Annahme!), könnten 15% des anthropogenen CO2-Ausstoßes kompensiert werden.[2] Da Meeresalgen zwischen 1000 und 1 Million Mal weniger Eisen als Kohlenstoff aufnehmen, würden geringe Eisenmengen genügen, um die Aufnahme großer Kohlendioxidmengen in die Pflanzen anzukurbeln.[1]
Nach wie vor gelten Düngungen in HNLC-Meeresregionen mit hohem Nährstoffangebot und geringer Chlorophyllkonzentration wie dem Nordpazifik, Äquatorialpazifik und dem Südlichen Ozean als sehr aussichtsreich. In den sogenannten LNLC-Regionen (Low Nutrient, Low Chlorophyll), in denen eine geringe Nährstoff- und eine geringe Chlorophyllkonzentration vorherrscht, würde eine Düngung hingegen das Phytoplanktonwachstum nur sehr geringfügig anregen, da neben dem Eisen andere Nährstoffe fehlen, die den Stoffwechsel des Phytoplanktons anregen. Unter den HNLC-Meeren besitzt der Südliche Ozean das höchste Nährstoffaufkommen in der obersten Wasserschicht und bietet damit das größte Potential für die CO2-Sequestration. Ursprungsgebiet für die südlich der Polarfront aufsteigenden nährstoffreichen Wassermassen ist zum größten Teil der Nordatlantik. Ein weiterer Vorteil des Südlichen Ozeans ist, dass es hier sehr wolkig und sturmreich ist, sodass das Phytoplankton weniger UV-Schäden erleidet als in ruhigen und sonnigen Meeresregionen.[3]
Die zusätzlichen Kohlenstoffemissionen, die durch die Eisendüngung erzeugt würden, wären nur geringfügig. Allerdings ist 1 Gigatonne Kohlenstoff im Vergleich zu einem jährlichen Zuwachs von 3,5 Gigatonnen CO2 nicht sehr viel. Das Meer enthält bereits 38 000 Gigatonnen gelösten anorganischen Kohlenstoff, Hydrogenkarbonat, Karbonat und gelöstes CO2. Der Zusatz durch Düngung würde daher keinen großen Unterschied machen.[4] Außerdem wird zwar relativ viel CO2 in den Südlichen Ozean eingetragen, dieses wird aber nur geringfügig gespeichert. Das liegt daran, dass CO2 nordwärts in die Subtropische Konvergenzzone transportiert wird. Die Subtropische Konvergenzzone befindet sich etwa auf dem 44. Breitengrad (Südhalbkugel); dort trifft warmes Wasser aus den Subtropen auf kaltes polares Wasser. Es herrscht Auftrieb, welcher das Absinken und damit die Speicherung des CO2 verhindert. Zudem hängt die CO2-Aufnahme der Meere auch von der biologischen Aktivität in den Meeren, deren Zirkulation und Temperatur ab. Diese Faktoren werden vom Klimawandel beeinflusst. Bis jetzt ist die Effizienz bzw. Wirksamkeit der Methode noch nicht belegt, und auch die negativen Folgen sind unzureichend erforscht.[4]
Nebeneffekte
Änderung der Artenzusammensetzung
Es gibt deutliche Belege für Veränderungen der Artenkomposition durch die Eisendüngung, insbesondere in der euphotischen Zone der pelagischen (küstenfernen) Ökosysteme; diese befinden sich im freien Wasser der Meere. Die Artengemeinschaft des Phytoplanktons ändert sich ebenfalls durch die Eisendüngung. Zusätzlich wird eine Verschiebung der Dominanz kleiner Phytoplanktonarten zu der Dominanz großer Diatomeen (Kieselalgen) erwartet. Die Gefährdungen, die von der Artenzusammensetzung des Planktons auf die pelagischen und benthischen Ökosysteme (letztere sind in der Bodenzone des Meeres angesiedelt) ausgeht, sind schwer vorherzusagen.[5]
Anregung toxischer Algenblüte
Die Eisendüngung kann zu der Bildung toxischer Algenblüten führen. Im Zuge der Freilandstudie CROZEX (The Crozet Natural Iron Bloom and Export Experiment), die im Südlichen Ozean stattfand, konnte eine deutliche Zunahme der Alge Phaecystis antarctica, einer weitverbreiteten Algenart und wichtiger Bestandteil des Phytoplanktons im südlichen Ozean, in der Größe, der Anzahl und der Biomasse gezeigt werden. Die Veränderungen zeigten auch Auswirkungen auf höhere, d.h. nährstoffreichere, Trophiestufen der Nahrungskette, da größere Algen für die dort vorkommenden Mesozooplankton-Arten nicht als Nahrung nutzbar sind. Beim Mesozooplankton handelt es sich um planktonische Tiere, die 0.2 – 20 mm groß sind; zum Mesozooplankton zählen unter anderem einige Ruderfußkrebsarten. Zusätzlich ist eine Veränderung der Struktur und der Funktion des pelagischen Ökosystems bei einer systematischen und großskaligen Eisendüngung sehr wahrscheinlich. Bei langfristigen Anwendungen werden Auswirkungen auf die pelagische Fischerei erwartet.
Neben der Alge Phaecystis antarctia wurde die Algengattung „Pseudo-nitzschia“ durch die Eisenzugaben stark begünstigt. Sie produziert Domoinsäure, die sich in der Nahrungskette anreichert und als Nervengift Säugetiere schädigen kann. Auch die toxische Algenblüte ist schwer vorhersagbar und beeinträchtigt die planktischen Lebensgemeinschaften.[5]
Verschärfung sauerstoffarmer Zonen
Die durch die Eisendüngung zusätzlich erzeugte Biomasse könnte vermehrt den Sauerstoff zehren, den Fische und andere Tiere benötigen: Im gut belüfteten Südlichen Ozean ist dieser Effekt relativ gering, allerdings könnte es Fernwirkungen geben und die Situation in den bereits vorhandenen Sauerstoffminimumzonen der Weltozeane verschärfen. Die möglichen Folgen der Eisendüngung auf die Artenvielfalt und auf die marine Nahrungskette auf Zeitskalen, die über die wenigen Wochen der bisherigen Eisendüngungsexperimente hinausgehen, wurden bis jetzt nicht ausreichend untersucht.[1] Zusätzlich könnte es durch die infolge der Eisendüngung erzielte Algenblüte und den damit verstärkten Abfluss von partikulärer organischer Materie und Remineralisierung zu sauerstoffarmen Zonen im Meer kommen, sodass anoxische Verhältnisse zu einem Massensterben von Meeresorganismen führen könnten. Da das nährstoffreiche, aber sauerstoffarme Tiefenwasser den anaeroben mikrobiologischen Abbau erhöht, besteht die Gefahr, dass andere treibhausschädliche Gase wie Methan und Lachgas gebildet werden. Das könnte den Effekt der Eisendüngung mindern, und der Auftrieb des Tiefenwassers könnte letztlich zu einem Fischsterben in Küstenregionen führen.[4] [5]
Außerdem könnte es zu einer drastischen Reduktion der Biodiversität benthischer Lebensgemeinschaften bis hin zum Absterben kommen. Bei extremen Ausprägungen ist sogar die starke Freisetzung von Schwefelwasserstoff in Regionen benthischer Sauerstoffarmut möglich, was das dauerhafte Absterben der meisten marinen Organismen bedeuten würde.[5]
Veränderung des Nahrungsnetzes
Es wird befürchtet, dass der Eiseneintrag den Nährstoffhaushalt in anderen Regionen stören könnte. Außerdem könnte das verstärkte Algenwachstum dazu führen, dass Makronährstoffe im Oberflächenwasser aufgebraucht werden könnten, sodass es zu einem Nährstoffmangel in anderen, vom Düngungsgebiet stromabwärts gelegenen Meeresgebieten kommen könnte. Das gilt allerdings nicht für den Südlichen Ozean; hier verweilt das Oberflächenwasser nur relativ kurz an der Meeresoberfläche und taucht ab, bevor Makronährstoffe ausgeschöpft sind. Diese Wassermassen gelangen erst nach Hunderten von Jahren wieder an die Oberfläche. Der Südliche Ozean ist also am besten für die CO2-Sequestrierung geeignet.[1] Außerdem könnte es zu der Abnahme essentieller Nährstoffe kommen, wie z.B. von Stickstoff, Phosphor und Silizium. Der gesamte Nährstoffhaushalt und -transport in der Wassersäule wird verändert und langfristig wird die biologische Produktivität des Systems reduziert. Das kann auch zu signifikanten Einbußen in den Fischereierträgen führen.[5]
Verstärkung der Versauerung
Hauptartikel: Ozeanversauerung
Zu den unerwünschten Nebenwirkungen der Eisendüngung zählt auch, dass der vermehrte Abbau von organischem Material und der verstärkte Eintrag von Kohlendioxid in tiefere Wasserschichten vor Ort zur Ozeanversauerung beitragen.[1]
Erkenntnisse
Die Effekte der Ozeandüngung wurden seit 1993 in 13 Freilandexperimenten untersucht, die räumlich (< 300km²) und zeitlich (< 40 Tage) begrenzt durchgeführt wurden. Überwiegend wurde die Wirkung von Eisendünger untersucht. Bei den Experimenten trat die Grundvoraussetzung einer effektiven CO2-Speicherung, nämlich das Absinken des Phytoplankton, nicht oder nur in geringem Ausmaß ein.[2] CROZEX zeigte in 2004, dass relativ zu einer Einheit an zugefügtem Eisen die Menge an Kohlenstoff, die in eine Tiefe von 200m sequestriert wurde, etwa 80 mal geringer war, als Wissenschaftler während einer ähnlichen Studie in der nahegelegen Kerguelen-Region festgestellt hatten.
Die Ergebnisse waren also eher ernüchternd: Selbst wenn die gesamte Ozeanoberfläche der Welt an Eisenmangel leiden würde, würde mit einer Sättigung kein großer Effekt auf den atmosphärischen CO2-Gehalt erreicht werden. Die Ergebnisse der Studien waren außerdem nicht sehr repräsentativ, da das System durch die massive Eisenzufuhr über einen relativ kurzen Zeitraum geschockt wurde.[3] Die Ergebnisse der Experimente werden auch durch Modellstudien gestützt, die zeigten, dass die Effizienz der Eisendüngung gering ist und der Großteil des Kohlenstoffs (bis zu 80%) wieder freigesetzt wird.
Neben der mangelnden Effizienz gibt es weitere Bedenken gegenüber der Eisendüngung, da große Flächen gedüngt werden müssten. Außerdem würde die Wirkung der Ozeandüngung erst sehr spät einsetzen, denn Phytoplankton sinkt nur sehr langsam ab und die globale Mitteltemperatur ändert sich nur verzögert mit der Änderungen der CO2-Konzentration der Atmosphäre. Ein weiterer Faktor ist, dass die Düngung sehr lange aufrechterhalten werden müsste, um den atmosphärischen CO2-Gehalt nachhaltig zu beeinflussen. Zum Schluss sollte berücksichtigt werden, dass von der potentiell gespeicherten Menge an CO2 wieder die CO2-Emissionen abgezogen werden müssen, die bei der Herstellung des Düngers, beim Transport und bei der Ausbringung entstehen.
Zusätzlich widerspricht die Eisendüngung der globalen, europäischen und regionalen Meeresschutzpolitik, deren Ziel die Reduktion der Eutrophierung ist.[2] Über die Düngung mit Phosphor und Stickstoff gibt es nur wenige Erkenntnisse. Ein Nachweis für die Wirksamkeit der Ozeandüngung wurde bislang also nicht erbracht.
Experimente zur Meeresdüngung
Die bisher 13 internationalen Experimente stützen die Hypothese von Martin (s.o.) in zwei Punkten: 1. Eisenmangel wirkt sich begrenzend auf die Primärproduktion in Meeren mit hohen Stickstoff- und Phosphorkonzentrationen im Oberflächenwasser aus. 2. Durch Eisendüngung kann die Biomasse des Phytoplanktons kurzfristig erhöht werden. Allerdings ist bis jetzt unklar, ob die Zugabe von Eisen zu einem erhöhten Übergang von Kohlenstoff aus der Atmosphäre über den Oberflächenwasserkörper zum Meeresboden führt.[5]
LOHAFEX

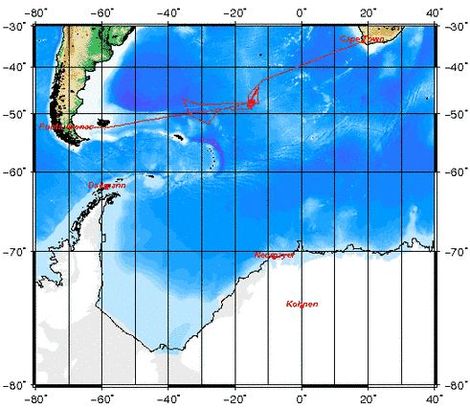
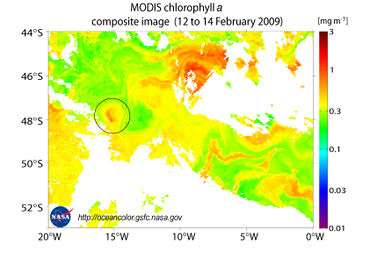
LOHAFEX ist das jüngste Eisendüngungsexperiment und eine deutsch-indische Kooperation. Es wurde vom Alfred-Wegener-Institut 2009 im Südlichen Ozean durchgeführt. Das Wort LOHAFEX setzt sich aus dem Hindi-Wort für Eisen („Loha“) und der Abkürzung für Fertilistation Experiment („Fex“) zusammen. Ziel war es, das schnelle Wachstum von Meerespflanzen (Phytoplankton) anzuregen. Dafür wurde eine 300 km² große Flache mit gelöstem Eisensulfit gedüngt. Der Zeitraum der Studie betrug sieben Wochen, während derer die Auswirkungen der Algenblüte auf den Austausch von CO2 zwischen Meer und Atmosphäre, die Plankton-Nahrungsketten und die Organismen des Meeresbodens untersucht wurden. Zusätzlich wurden die Auswirkungen auf Krill untersucht, deren Bestände in den letzten Jahrzehnten um mehr als 80% zurückgegangen sind. Es bestand die Hoffnung, dass sich die Bestände durch die Eisendüngung wieder erholen könnten.
Vor der Eisenzugabe wurde zunächst eine geeignete Untersuchungsstelle gesucht; die Kriterien hierfür waren, dass es sich um einen möglichst geschlossenen und damit stabilen Ozeanwirbel handelte.[4] Die Ergebnisse der Studie waren, dass die Zugabe von Eisen das Wachstum von Phytoplankton zwar angeregt hat, allerdings nur für einen kurzen Zeitraum. Durch den hohen Fraßdruck durch Ruderfußkrebse (Copepoden) sank allerdings nur eine geringe Menge an Kohlenstoff auf den Meeresboden ab, sodass die CO2-Aufnahme durch den Ozean geringer ausfiel als bei früheren Düngungsexperimenten.
Bei vorherigen Experimenten wurden größere Blüten vor allem bei Kieselalgen erzeugt. Kieselalgen besitzen eine harte Silikatschale, die sie vor Fressfeinden schützt; nach der Blüte sinken sie auf den Meeresboden. In dem Untersuchungsgebiet der Lohafex-Studie war die Kieselsäure, die essentiell für das Wachstum der Kieselalgen ist, durch die vorhergehenden Blüten bereits aufgezehrt worden. Durch Eisendüngung kann also das Wachstum anderer Kleinalgen stimuliert werden, die Kieselalgen bilden jedoch die größte Blüte, da sie keine Fressfeinde haben. Eine Eisendüngung der subantarktischen Zone würde damit sehr wahrscheinlich nicht dazu führen, dass große Mengen CO2 aus der Atmosphäre im Ozean gebunden werden würden. Die Befürchtung, dass sich die Konzentrationen anderer Treibhausgase wie Lachgas oder Methan ändern würden, erfüllte sich nicht oder nur in vernachlässigbaren Größenordnungen.[6]
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 World Ocean Review (2010): Mit den Meeren leben – ein Bericht über den Zustand der Weltmeere.
- ↑ 2,0 2,1 2,2 2,3 Umweltbundesamt (2011): Geo-Engineering. Wirksamer Klimaschutz oder Größenwahn?
- ↑ 3,0 3,1 3,2 3,3 Hanetzog, K. (2009):Die Eisendüngung der Ozeane – Hintergrund, Entwicklung und Kenntnisstand, Seminararbeit TU Bergakademie Freiberg.
- ↑ 4,0 4,1 4,2 4,3 Smetacek, V., Naqvi, S.W.:LOHAFEX: Deutsch-indisches Forschungsexperiment zur Eisendüngung des Meeres.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Bundesamt für Naturschutz (2009): Stellungnahme des Bundesamtes für Naturschutz zum AWI-Projekt LOHAFEX.
- ↑ AWI (2009):Polarsternexpedition Lohafex gibt neue Einblicke in die Planktonökologie - Wenig atmosphärisches Kohlendioxid im Südlichen Ozean gebunden.
Weblinks
- Leujak, W., H. Gienzky & U. Claussen (2011): Eisendüngung – Mehr CO2-Fixierung durch das Meer?; in: J. Lozan (Hg.): Warnsignal Klima: Die Meere - Änderungen & Risiken
- AWI (2012): Pressemitteilung zu EIFEX, einem weiteren Eisendüngungsexperiment
- Wallace, D., et al. (2010): Ocean Fertilization. A scientific summary for policy makers
- Yoon,J.-E., et al. (2018): Reviews and syntheses: Ocean iron fertilization experiments – past, present, and future looking to a future Korean Iron Fertilization Experiment in the Southern Ocean (KIFES) project, Biogeosciences, 15, 5847–5889
Lizenzhinweis
| Dieser Artikel ist ein Originalartikel des Klima-Wiki und steht unter der Creative Commons Lizenz Namensnennung-Weitergabe unter gleichen Bedingungen 3.0 Deutschland. Informationen zum Lizenzstatus eingebundener Mediendateien (etwa Bilder oder Videos) können in den meisten Fällen durch Anklicken dieser Mediendateien abgerufen werden und sind andernfalls über Dieter Kasang zu erfragen. |