Ozon: Unterschied zwischen den Versionen
Anja (Diskussion | Beiträge) KKeine Bearbeitungszusammenfassung |
KKeine Bearbeitungszusammenfassung |
||
| (24 dazwischenliegende Versionen von 6 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
'''Ozon''' | '''Ozon''' O<sub>3</sub> (griechisch "das Riechende") ist ein aus drei Sauerstoffatomen bestehendes, instabiles Molekül, das innerhalb kurzer Zeit zu dimerem Sauerstoff O<sub>2</sub> zerfällt. Es ist ein starkes Oxidationsmittel. | ||
== Eigenschaften == | == Eigenschaften == | ||
| Zeile 6: | Zeile 6: | ||
== Bildung == | == Bildung == | ||
Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Grundgleichung | Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Grundgleichung | ||
[[Bild:Ozon1.png| | [[Bild:Ozon1.png|270px|center]] | ||
wobei ΔH die molare Reaktionsenthalpie bezeichnet. | wobei ΔH die molare Reaktionsenthalpie bezeichnet. | ||
Ozon bildet sich in der [[Atmosphäre]] vor allem auf drei Arten: | Ozon bildet sich in der [[Atmosphäre]] vor allem auf drei Arten: | ||
* Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der [[Stratosphäre]] in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 0,242 µm wird als Photodissoziation bezeichnet | * Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der [[Stratosphäre]] in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 0,242 µm wird als Photodissoziation bezeichnet: | ||
* In Erdnähe bildet sich Ozon aus einer Reaktion zwischen Stickstoffdioxid NO<sub>2</sub> und Sauerstoff O<sub>2</sub> unter dem Einfluss von UV-Strahlung | :'''O<sub>2</sub> + ''hv'' -> O + O''' | ||
:'''O + O<sub>2</sub> -> O<sub>3</sub>''' (2x) | |||
* In Erdnähe bildet sich Ozon aus einer Reaktion zwischen Stickstoffdioxid NO<sub>2</sub> und Sauerstoff O<sub>2</sub> unter dem Einfluss von UV-Strahlung: | |||
:'''NO<sub>2</sub> + ''hv'' -> NO + O''' | |||
:'''O + O<sub>2</sub> -> O<sub>3</sub>''' | |||
* Durch ein Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entsteht Ozon (aber auch Salpetersäure und andere Stoffe). | * Durch ein Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entsteht Ozon (aber auch Salpetersäure und andere Stoffe). | ||
== Vorkommen == | == Vorkommen und Entstehung von Ozon == | ||
=== Troposphärisches Ozon === | |||
* Hauptartikel: [[Troposphärisches Ozon]] | |||
In der Atemluft ist Ozon jedoch bereits in weit geringeren Konzentrationen gesundheitsschädlich, insbesondere bewirkt die lokal sehr unterschiedliche Ozonbelastung Reizungen der Atemwege. | |||
=== Stratosphärisches Ozon === | === Stratosphärisches Ozon === | ||
* Hauptartikel: [[Stratosphärisches Ozon]] | * Hauptartikel: [[Stratosphärisches Ozon]] | ||
Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in Parts per million (ppm,also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der [[Stratosphäre]] auf. Für seine Entstehung ist dort der Ozon-Sauerstoff-Zyklus verantwortlich. | Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in Parts per million (ppm,also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der [[Stratosphäre]] auf. Für seine Entstehung ist dort der Ozon-Sauerstoff-Zyklus verantwortlich. | ||
Ozon ist in der Stratosphäre unschädlich und [[Absorption|absorbiert]] teilweise die Ultraviolettstrahlung der Sonne. | Ozon ist in der Stratosphäre unschädlich und [[Absorption|absorbiert]] teilweise die Ultraviolettstrahlung der Sonne. | ||
=== | == Ozonabbau == | ||
* Hauptartikel: [[ | === Abbau von stratosphärischem Ozon === | ||
* ''Hauptartikel: [[Prozess::Ozonabbau in der Stratosphäre]]'' | |||
Seit Ende der 1970er Jahre wird das Gleichgewicht zwischen Ozonbildung und Ozonabbau zunehmend durch menschliche Einflüsse gestört. Ursache ist die anthropogene Emission von halogenierten Kohlenwasserstoffen (FCKW), die Chlor und Brom enthalten. FCKW-Moleküle gelangen erst nach mehreren Jahren bis in die Stratosphäre. Sie werden dort durch die starke UV-Strahlung der Sonne zerstört, wobei Chlor (bzw. Brom) frei wird, das dann die Ozonmoleküle angreift. Die Ozonabnahme ist in der gesamten Stratosphäre nachweisbar. | |||
=== Abbau von Ozon über den Polen === | |||
* Hauptartikel: [[Regionales Beispiel::Ozonloch über der Antarktis]] | |||
* Hauptartikel: [[Regionales Beispiel::Ozonabbau über der Arktis]] | |||
* Hauptartikel: [[ | |||
* Hauptartikel: [[Ozonabbau über der Arktis]] | |||
Über den Polen ist die Ozonabnahme am ausgeprägtesten. Die besonders starke Abnahme der Ozonkonzentration im Süd-Frühjahr über dem Südpol wird als [[Ozonloch über der Antarktis|Ozonloch]] bezeichnet. | |||
{{#set: | |||
umfasst=Stratosphärisches Ozon | |||
|umfasst=Troposphärisches Ozon | |||
|Prozess=Ozonveränderungen und Klimawandel | |||
|Prozess=Wirkung von Kohlendioxid und Ozon | |||
}} | |||
== Literatur == | == Literatur == | ||
* Katrin Palitzsch, Sabine Göllner, Kristina Lupa, Jörg Matschullat, Corinna Messal, Kirsten Pleßow, Mandy Schipek, Ivonne Schnabel, Christian Weller, Frank Zimmermann: ''Ozon in Waldökosystemen aus atmosphärenchemischer und pflanzenphysiologischer Sicht''. Umweltwissenschaften und Schadstoff-Forschung 17(4), S. 231 - 241 (2005), ISSN 0934-3504 | * Katrin Palitzsch, Sabine Göllner, Kristina Lupa, Jörg Matschullat, Corinna Messal, Kirsten Pleßow, Mandy Schipek, Ivonne Schnabel, Christian Weller, Frank Zimmermann: ''Ozon in Waldökosystemen aus atmosphärenchemischer und pflanzenphysiologischer Sicht''. Umweltwissenschaften und Schadstoff-Forschung 17(4), S. 231 - 241 (2005), ISSN 0934-3504 | ||
== | == Weblinks == | ||
*[ | * [http://www.umweltbundesamt.de/luft/schadstoffe/ozon.htm Ozon (O<sub>3</sub>)] Grundinformationen zum troposphärischen Ozon vom Umweltbundesamt (UBA) | ||
==Lizenzhinweise== | ==Lizenzhinweise== | ||
{ | {{Vorlage:Lizenzhinweis}} | ||
[[Kategorie:Ozon]] | [[Kategorie:Ozon]] | ||
Aktuelle Version vom 9. November 2011, 14:39 Uhr
Ozon O3 (griechisch "das Riechende") ist ein aus drei Sauerstoffatomen bestehendes, instabiles Molekül, das innerhalb kurzer Zeit zu dimerem Sauerstoff O2 zerfällt. Es ist ein starkes Oxidationsmittel.
Eigenschaften
Ozon ist bei Zimmertemperatur und normalem Luftdruck gasförmig. Aufgrund seiner oxidierenden Wirkung ist es für den Menschen giftig. Bei Ozonaufnahme treten beim Betroffenen häufig heftige Kopfschmerzen auf. In hohen Konzentrationen riecht das Gas aufgrund der oxidierenden Wirkung auf die Nasenschleimhaut charakteristisch stechend-scharf bis chlorähnlich, während es in geringen Konzentrationen geruchlos ist. Die Geruchsschwelle liegt bei 40 µg/m3, allerdings gewöhnt man sich schnell an den Geruch und nimmt ihn dann nicht mehr wahr.
Bildung
Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Grundgleichung
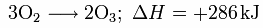
wobei ΔH die molare Reaktionsenthalpie bezeichnet.
Ozon bildet sich in der Atmosphäre vor allem auf drei Arten:
- Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der Stratosphäre in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 0,242 µm wird als Photodissoziation bezeichnet:
- O2 + hv -> O + O
- O + O2 -> O3 (2x)
- In Erdnähe bildet sich Ozon aus einer Reaktion zwischen Stickstoffdioxid NO2 und Sauerstoff O2 unter dem Einfluss von UV-Strahlung:
- NO2 + hv -> NO + O
- O + O2 -> O3
- Durch ein Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entsteht Ozon (aber auch Salpetersäure und andere Stoffe).
Vorkommen und Entstehung von Ozon
Troposphärisches Ozon
- Hauptartikel: Troposphärisches Ozon
In der Atemluft ist Ozon jedoch bereits in weit geringeren Konzentrationen gesundheitsschädlich, insbesondere bewirkt die lokal sehr unterschiedliche Ozonbelastung Reizungen der Atemwege.
Stratosphärisches Ozon
- Hauptartikel: Stratosphärisches Ozon
Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in Parts per million (ppm,also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der Stratosphäre auf. Für seine Entstehung ist dort der Ozon-Sauerstoff-Zyklus verantwortlich. Ozon ist in der Stratosphäre unschädlich und absorbiert teilweise die Ultraviolettstrahlung der Sonne.
Ozonabbau
Abbau von stratosphärischem Ozon
- Hauptartikel: Ozonabbau in der Stratosphäre
Seit Ende der 1970er Jahre wird das Gleichgewicht zwischen Ozonbildung und Ozonabbau zunehmend durch menschliche Einflüsse gestört. Ursache ist die anthropogene Emission von halogenierten Kohlenwasserstoffen (FCKW), die Chlor und Brom enthalten. FCKW-Moleküle gelangen erst nach mehreren Jahren bis in die Stratosphäre. Sie werden dort durch die starke UV-Strahlung der Sonne zerstört, wobei Chlor (bzw. Brom) frei wird, das dann die Ozonmoleküle angreift. Die Ozonabnahme ist in der gesamten Stratosphäre nachweisbar.
Abbau von Ozon über den Polen
- Hauptartikel: Ozonloch über der Antarktis
- Hauptartikel: Ozonabbau über der Arktis
Über den Polen ist die Ozonabnahme am ausgeprägtesten. Die besonders starke Abnahme der Ozonkonzentration im Süd-Frühjahr über dem Südpol wird als Ozonloch bezeichnet.
Literatur
- Katrin Palitzsch, Sabine Göllner, Kristina Lupa, Jörg Matschullat, Corinna Messal, Kirsten Pleßow, Mandy Schipek, Ivonne Schnabel, Christian Weller, Frank Zimmermann: Ozon in Waldökosystemen aus atmosphärenchemischer und pflanzenphysiologischer Sicht. Umweltwissenschaften und Schadstoff-Forschung 17(4), S. 231 - 241 (2005), ISSN 0934-3504
Weblinks
- Ozon (O3) Grundinformationen zum troposphärischen Ozon vom Umweltbundesamt (UBA)
Lizenzhinweise
|
Dieser Artikel basiert auf dem Artikel Ozon aus der freien Enzyklopädie Wikipedia und steht unter der Lizenz „Creative Commons Attribution/Share Alike“. In der Wikipedia ist eine Liste der Autoren verfügbar. |