Ozon: Unterschied zwischen den Versionen
Anja (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Anja (Diskussion | Beiträge) |
||
| Zeile 38: | Zeile 38: | ||
== Gesundheitsgefährdung == | == Gesundheitsgefährdung == | ||
Während | Während Ozon in der [[Stratosphäre]] überlebensnotwendig für uns ist, kann Ozon in der [[Troposphäre]], in der wir leben, in zu hohen Konzentrationen zu erheblichen Gesundheitsgefährdungen führen. | ||
* Hauptartikel: [[Troposphärisches Ozon]] | * Hauptartikel: [[Troposphärisches Ozon]] | ||
* Hauptartikel: [[Stratosphärisches Ozon]] | * Hauptartikel: [[Stratosphärisches Ozon]] | ||
Version vom 14. Dezember 2008, 12:35 Uhr
Ozon (O3)(griechisch "das Richende") ist ein aus drei Sauerstoffatomen bestehendes, instabiles Molekül, das innerhalb kurzer Zeit zu dimerem ("normalem") Sauerstoff (O2) zerfällt. Es ist ein starkes Oxidationsmittel.
Eigenschaften
Ozon ist bei Zimmertemperatur und normalem Luftdruck gasförmig. Aufgrund seiner oxidierenden Wirkung ist es für den Menschen giftig. Bei Ozonaufnahme treten beim Betroffenen häufig heftige Kopfschmerzen auf. In hohen Konzentrationen riecht das Gas aufgrund der oxidierenden Wirkung auf die Nasenschleimhaut charakteristisch stechend-scharf bis chlorähnlich, während es in geringen Konzentrationen geruchlos ist. Die Geruchsschwelle liegt bei 40 µg/m3, allerdings gewöhnt man sich schnell an den Geruch und nimmt ihn dann nicht mehr wahr.
Bildung
Ozon entsteht aus gewöhnlichem Sauerstoff gemäß der Grundgleichung
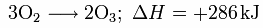
wobei ΔH die molare Reaktionsenthalpie bezeichnet.
Ozon bildet sich in der Atmosphäre vor allem auf drei Arten:
- Energiereiche Sonnenstrahlung spaltet Sauerstoff-Moleküle in der Stratosphäre in zwei einzelne Atome, die sich jeweils mit einem weiteren Sauerstoff-Molekül zu Ozon vereinigen. Dieser Vorgang der Spaltung von Sauerstoff-Molekülen durch energiereiche UV-C-Strahlung mit einer Wellenlänge von < 0,242 µm wird als Photodissoziation bezeichnet.
- In Erdnähe bildet sich Ozon aus einer Reaktion zwischen Stickstoffdioxid NO2 und Sauerstoff O2 unter dem Einfluss von UV-Strahlung.
- Durch ein Gewitter: Durch den elektrischen Stromfluss zwischen Wolke und Erdboden bei der Blitzentladung entsteht Ozon (aber auch Salpetersäure und andere Stoffe).
Vorkommen
Die Menge an Ozon in der Atmosphäre wird in Dobson-Einheiten (also pro Erdoberfläche) oder in Parts per million (ppm,also pro Stoffmenge Luft) angegeben. Die höchste Konzentration mit einigen ppm weist Ozon in der Stratosphäre auf. Für seine Entstehung ist dort der Ozon-Sauerstoff-Zyklus verantwortlich. Ozon ist in der Stratosphäre unschädlich und absorbiert teilweise die Ultraviolettstrahlung der Sonne. In der Atemluft ist es jedoch bereits in weit geringeren Konzentrationen gesundheitsschädlich, insbesondere bewirkt die lokal sehr unterschiedliche Ozonbelastung Reizungen der Atemwege.
In Reinluftgebieten ist die Ozon-Konzentrationen im Sommer oft höher als in Städten. Dies ist darauf zurückzuführen, dass durch die vielen Autoabgase in den Städten die Konzentration des Stickoxides NO sehr hoch sein kann. NO wirkt jedoch der Ozonbildung entgegen. Im einzelnen laufen folgende Reaktionen ab:
Ozon entsteht wie folgt:
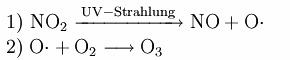
Gleichzeitig wird Ozon durch NO wieder abgebaut:
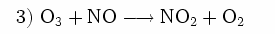
Wären nicht noch weitere Stoffe, sogenannte flüchtige Kohlenwasserstoffe oder auch CO, in der unteren Luftschicht vorhanden, würde sich kein weiteres Ozon bilden, sondern abhängig von der Sonneneinstrahlung stellt sich dann ein Gleichgewicht zwischen O3, NO und NO2 ein. Je stärker die Sonne scheint, desto mehr Ozon und weniger NO2 ist vorhanden, da letzteres ja durch die UV-Strahlung gespalten wird (Reaktion 1).
In der (verschmutzten) planetaren Grenzschicht der Atmosphäre finden sich aber, wie schon angedeutet, auch Kohlenwasserstoffe, die sowohl vom Menschen (anthropogen) also auch von der Vegetation (biogen) emittiert werden. Sie werden von OH-Radikalen, dem „Waschmittel der Atmosphäre“, oxidiert, wobei Peroxid-Radikale R-O-O• entstehen. Diese wiederum sorgen dafür, dass NO zu NO2 oxidiert wird, ohne dass dabei ein O3 „verbraucht“ wird wie in Reaktion 3, also:
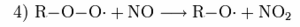
Da NO durch Autos und Industrie ausgestoßen wird, wird Ozon in der Stadt schneller wieder abgebaut (nach Reaktion 3) als in ländlichen Gegenden. Außerdem finden sich in ländlichen Gebieten häufig Kohlenwasserstoffe, die leichter von OH-Radikalen angegriffen werden können, wodurch Reaktion 4 schneller abläuft. Ein prominentes Beispiel für so einen leicht abbaubaren biogenen Kohlenwasserstoff ist Isopren.
Die im Zusammenhang mit der Ozonschicht häufig erwähnten FCKW (Fluorchlorkohlenwasserstoffe) werden durch UV-Strahlung gespalten, wodurch freie Chlorradikale entstehen, die wiederum viele Ozon-Moleküle „zerstören“ können.
Gesundheitsgefährdung
Während Ozon in der Stratosphäre überlebensnotwendig für uns ist, kann Ozon in der Troposphäre, in der wir leben, in zu hohen Konzentrationen zu erheblichen Gesundheitsgefährdungen führen.
- Hauptartikel: Troposphärisches Ozon
- Hauptartikel: Stratosphärisches Ozon
Einzelnachweise
Literatur
- Katrin Palitzsch, Sabine Göllner, Kristina Lupa, Jörg Matschullat, Corinna Messal, Kirsten Pleßow, Mandy Schipek, Ivonne Schnabel, Christian Weller, Frank Zimmermann: Ozon in Waldökosystemen aus atmosphärenchemischer und pflanzenphysiologischer Sicht. Umweltwissenschaften und Schadstoff-Forschung 17(4), S. 231 - 241 (2005), ISSN 0934-3504
- Georg Erlwein: Über Trinkwasserreinigung durch Ozon und Ozonwasserwerke. Leineweber, Leipzig 1904 (Digitalisat als PDF)
Siehe auch
- Wirkung von Kohlendioxid und Ozon
- Ozonabbau in der Stratosphäre
- Ozonloch über der Antarktis
- Ozonabbau über der Arktis
- Ozonveränderungen und Klimawandel
Weblinks
- [1] Aktuelle Immissionsdaten aus den Messnetzen der Bundesländer und des UBA
Lizenzhinweise
|
Dieser Artikel basiert auf dem Artikel Ozon aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |